Samarium(II)-iodid (SmI2) ist eine chemische Verbindung aus den Elementen Samarium und Iod. Samarium(II)-iodid ist ein tiefgrüner bis schwarzer Feststoff, es löst sich in Wasser mit tiefroter Farbe. Seine besondere Bedeutung erlangte es erst durch seine vielfältige Verwendung bei Synthesen in der Organischen Chemie. Samarium(II)-iodid wurde zusammen mit Ytterbium(II)-iodid (YbI2) als Reagenz für organische Synthesen eingeführt.
Darstellung
Samarium gehört zu den Lanthanoiden und besitzt die Elektronenkonfiguration [Xe] 4f6 6s2. In seinen Verbindungen kommt es bevorzugt in der Oxidationsstufe 3 und seltener in der Oxidationsstufe 2 vor.
Über Samarium(II)-iodid wurde erstmals 1906 berichtet. Samarium(II)-iodid ist nicht durch direkte Umsetzung aus den Elementen zugänglich, auf diesem Weg bildet sich nur Samarium(III)-iodid.
Die Darstellung von Samarium(II)-iodid gelingt durch Reduktion von wasserfreiem Samarium(III)-iodid im Wasserstoffstrom bei etwa 750 °C:
Die Darstellung von Samarium(II)-iodid kann auch durch Reduktion von Samarium(III)-iodid mit metallischem Samarium erfolgen:
Etabliert hat sich die Darstellung über Samariummetall und 1,2-Diiodethan in Tetrahydrofuran (THF) bei Raumtemperatur. Aufgrund der Empfindlichkeit der Reagenzien muss dabei wasserfrei und unter Inertgas gearbeitet werden. Bei Anwesenheit von Sauerstoff erfolgt ansonsten eine rasche Oxidation zum Samarium(III). Dies ist optisch an der Farbänderung von dunkelblauer zu gelber Lösung erkennbar. Das Reagenz ist kommerziell als dunkelblaue 0,1 M-Lösung in THF erhältlich, ist jedoch auf Dauer instabil, so dass es besser frisch hergestellt werden sollte.
Ferner kann auch Samariummetall mit Quecksilber(II)-iodid oder mit Iod in THF umgesetzt werden.
Eigenschaften
Physikalische Eigenschaften
Samarium(II)-iodid ist ein tiefgrüner bis schwarzer Feststoff, der sich in Wasser mit tiefroter Farbe löst. SmI2 beginnt bei 0,01 Torr ab 680 °C wiederum in Sm und SmI3 zu disproportionieren und schmilzt unter deutlicher Zersetzung bei 840 °C; dabei gibt das SmI3 wiederum Iod ab. Der Schmelzpunkt kann daher nicht genau bestimmt werden.
Chemische Eigenschaften
Das Redoxpotential Sm2 /Sm3 beträgt −1,55 V, daher ist es ein starkes Reduktionsmittel. Samarium(II)-iodid ist außerdem sehr luft- und feuchtigkeitsempfindlich. Es wird an Luft rasch zu Samarium(III) oxidiert. Die wässrige Lösung zersetzt sich im Laufe von etwa 15 min unter Wasserstoffentwicklung und weitgehender Entfärbung; dabei scheiden sich basische Iodide ab. Mit Säuren verläuft die Reaktion stürmisch.
Verwendung
Samarium(II)-iodid eignet sich in großer Vielfalt für Standardreaktionen:
- Reduktionen (selektives Einelektron-Reduktionsmittel)
- Ringöffnungsreaktionen
- Ringschlussreaktionen
- Dimerisierungen
Einzelnachweise
Literatur
- Henri B. Kagan, Jean-Louis Namy: „Lanthanides in organic synthesis“, in: Tetrahedron, 1986, 42 (24), S. 6573–6614; doi:10.1016/S0040-4020(01)82098-6.
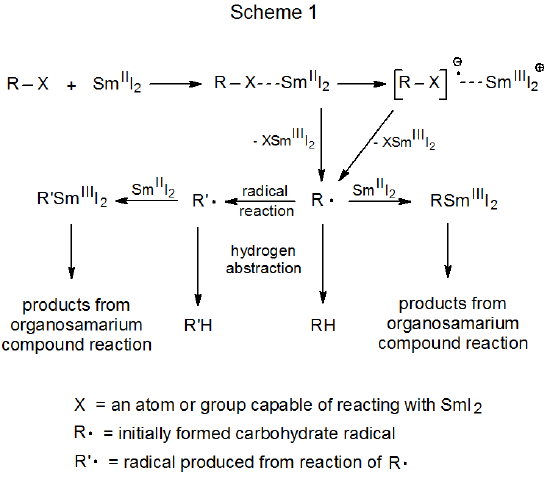
- Dennis P. Curran, Thomas L. Fevig, Craig P. Jasperse, Michael J. Totleben: „New Mechanistic Insights into Reductions of Halides and Radicals with Samarium(II) Iodide“, in: Synlett, 1992, S. 943–961; doi:10.1055/s-1992-21544.
- Gary A. Molander, Christina R. Harris: „Sequencing Reactions with Samarium(II) Iodide“, in: Chem. Rev., 1996, 96 (1), S. 307–338; doi:10.1021/cr950019y.
- Patrick G. Steel: „Recent developments in lanthanide mediated organic synthesis“, in: J. Chem. Soc., Perkin Trans. 1, 2001, S. 2727–2751; doi:10.1039/a908189e.
- Henri B. Kagan: „Twenty-five years of organic chemistry with diiodosamarium: an overview“, in: Tetrahedron, 2003, 59 (52), S. 10351–10372; doi:10.1016/j.tet.2003.09.101.
- Yusuke Asano, Shoko Suzuki, Tadashi Aoyama, Kosuke Shimizu, Masatsugu Kajitani, Yasuo Yokoyama: „Novel and Efficient Cyanofluoromethylation Promoted by Samarium(II) Species“, in: Synthesis, 2007, S. 1309–1314; doi:10.1002/chin.200736068.
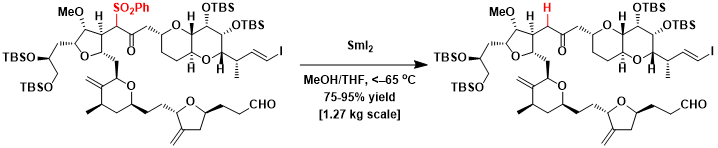
- K. C. Nicolaou, Shelby P. Ellery, Jason S. Chen: „Samarium Diiodide Mediated Reactions in Total Synthesis“, in: Angew. Chem. Int. Ed., 2009, 48 (39), S. 7140–7165; doi:10.1002/anie.200902151; PMID 19714695; PMC 2771673 (freier Volltext).
- David J. Procter, Robert A. Flowers II, Troels Skydstrup: "Organic Synthesis Using Samarium Diiodide", 2009, Royal Society of Chemistry, ISBN 978-1-84755-110-8.
Weblinks